|
Streszczenie: Obecność gronkowca złocistego (Staphylococcus aureus) stwierdza się w zmianach skórnych u większości chorych na wyprysk atopowy. Mimo że wyprysk atopowy nie jest dermatozą bakteryjną, wykazano korelację między liczebnością gronkowców w obrębie zmian wypryskowych a nasileniem stanu zapalnego. Powiązanie to tłumaczy się reakcją układu odpornościowego na toksyny wydzielane przez gronkowce. Obserwacje kliniczne pokazują, że leczenie przeciwgronkowcowe stanowi istotny element postępowania w wyprysku atopowym i może redukować zapotrzebowanie na kortykosterydy. Niniejszy artykuł omawia mechanizm działania superantygenów gronkowcowych, objawy kliniczne oraz strategie postępowania leczniczego w zakażonym wyprysku atopowym. Słowa kluczowe: wyprysk atopowy, atopowe zapalenie skóry, gronkowiec złocisty, leczenie. |
Wyprysk atopowy (atopowe zapalenie skóry) stanowi jedną z najczęstszych chorób skóry. W populacji polskich absolwentów średnich szkół zawodowych obecność aktywnego wyprysku atopowego stwierdzono u 2,9%, zaś występowanie tej choroby kiedykolwiek w przeszłości - u 3,7% [1]. Mimo że wyprysk atopowy nie jest chorobą bakteryjną, to uderza częste współwystępowanie zakażenia lub kolonizacji gronkowca złocistego (Staphylococcus aureus) w tej chorobie. Obecność gronkowca złocistego stwierdza się w zmianach skórnych u bez mała 100% chorych na wyprysk atopowy, podczas gdy w populacji generalnej jest on obecny na skórze 5-30% osób [2,3]. Wykazano korelację między liczebnością gronkowców w obrębie zmian wypryskowych a nasileniem stanu zapalnego [4]. Związek ten tłumaczy się reakcją komórek układu odpornościowego na toksyny wydzielane przez gronkowce. Toksyny te, określane mianem superantygenów, powodują nieswoistą aktywację komórek T, które inicjują proces zapalny w skórze. 65% szczepów gronkowca złocistego wyizolowanych ze zmian wypryskowych produkuje enterotoksyny o działaniu superantygenowym [5,6]. Przytoczone obserwacje stanowią racjonalną podstawę dla stosowania leczenia przeciwgronkowcowego w wyprysku atopowym. Wyjaśniają też, dlaczego w nasilonym wyprysku skojarzenie słabego kortykosterydu i leku przeciwbakteryjnego daje nierzadko lepszy efekt leczniczy od silnego kortykosterydu w monoterapii [7].
Rola gronkowca złocistego (Staphylococcus aureus) w wyprysku atopowym (WA) jest przedmiotem dyskusji trwającej od kilku dekad [8]. Za znaczeniem tej bakterii w patogenezie wyprysku atopowego przemawiają obserwacje kliniczne. W jednym z londyńskich szpitali, kliniczne cechy zakażenia gronkowcowego stwierdzono u 28 spośród 30 pacjentów z nowo rozpoznanym wypryskiem atopowym; u 27 chorych obecność gronkowca złocistego w ogniskach wyprysku potwierdzono mikrobiologicznie [7]. W klinice dermatologicznej w Hanowerze, spośród 66 chorych na wyprysk atopowy, u 62 stwierdzono nosicielstwo gronkowca złocistego: u 51 chorych (77%) bakteria ta była obecna zarówno w ogniskach wyprysku, jak i w nozdrzach przednich, u siedmiu (11%) - wyłącznie na skórze, a u czterech (6%) - tylko w nozdrzach. Leczenie przeciwgronkowcowe nosicieli doprowadziło do znamiennego złagodzenia objawów wyprysku [9].
Jak wiadomo, zakażenie gronkowcem złocistym może powodować różnorodne stany chorobowe skóry, takie jak zapalenie mieszków włosowych (folliculitis), czyrak (furunculus) i czyrak gromadny (carbunculus), ropnie mnogie pach (hidradenitis suppurativa), ropnie mnogie niemowląt (abscessus multiplices infantum), czy w końcu liszajec pęcherzowy (impetigo bullosa). Choroby te nie przypominają jednak wyprysku atopowego ani obrazem klinicznym, ani przebiegiem. Wiadomo również, że wyprysk atopowy nie jest chorobą o etiologii bakteryjnej, lecz alergiczną chorobą zapalną, u której podłoża leży interakcja między czynnikami wrodzonymi (genotyp) a wpływami środowiska.
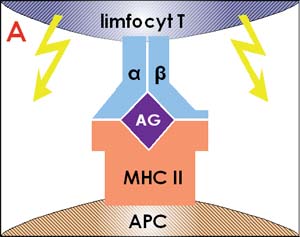
Jaka jest zatem rola gronkowca złocistego w patomechanizmie wyprysku atopowego? Odpowiedzi na to pytanie dostarczyli badacze duńscy, którzy wykazali, że do wywołania zmian wypryskowych nie jest konieczna obecność żywego gronkowca, lecz wystarcza zaaplikowanie na skórę produktu tej bakterii - enterotoksyny B [10]. Ta gronkowcowa enterotoksyna należy do grupy substancji określanych mianem superantygenów, które od typowych antygenów różnią cechy bardzo istotne z biologicznego punktu widzenia [11]. Typowe antygeny ulegają wychwyceniu przez komórkę prezentującą antygen (APC), która przetwarza je i umieszcza w obrębie kompleksu zgodności tkankowej (MHC) klasy II na swojej powierzchni. W takiej formie antygen jest przedstawiany limfocytom T. W przypadku dopasowania przestrzennego antygenu, MHC II, oraz receptora limfocytu T (TCR), dochodzi do aktywacji tej komórki (ryc. 1 A). W pozostałych przypadkach limfocyt pozostaje niepobudzony. Oznacza to, że w przypadku wykrycia obecności obcego białka dochodzi do aktywacji i podziałów ściśle określonego, swoistego klonu limfocytów T.
 |
 |
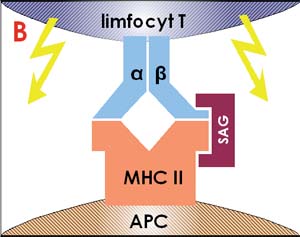
W odróżnieniu od wyżej opisanej typowej sytuacji, superantygeny aktywują limfocyty T w sposób nieswoisty, tworząc swoiste "krótkie spięcie" między białkiem MHC II a łańcuchem β receptora limfocytu T (ryc. 1 B). W tej sytuacji dochodzi do nieswoistej aktywacji i podziałów licznych klonów limfocytów T, mimo, że miejsce prezentacji antygenu na MHC II pozostaje puste. W normalnych warunkach 5-10% wszystkich limfocytów posiada receptory zawierające łańcuch β, jednak w obecności superantygenów odsetek ten szybko rośnie na skutek ekspansji pobudzonych komórek. Pobudzone komórki produkują cytokiny, których efekt biologiczny uzewnętrznia się nasileniem wyprysku [12]. Przykładem cytokin o istotnym znaczeniu w patogenezie wyprysku atopowego wydzielanych przez limfocyty T w odpowiedzi na superantygeny są interleukina 4 [13] i interleukina 13 [14]. Enterotoksyny gronkowcowe stymulują ponadto wydzielanie histaminy i leukotrienów - ważnych mediatorów zapalenia alergicznego [15].
Zakażenie wyprysku gronkowcem złocistym można podejrzewać w przypadku obecności przeczosów (excoriatio - zdarcie naskórka na skutek drapania), sączenia oraz strupów zaschniętej wydzieliny. Obraz taki określany jest mianem impetiginizacji lub zliszajcowacenia i zwykle w takiej sytuacji stwierdza się znaczne ilości gronkowców w obrębie zmian [16]. Jednak w opinii Chu [7] obecność przeczosów na powierzchni grudek jest wskaźnikiem infekcji/kolonizacji gronkowcowej nawet przy nieobecności wysięku czy żółtawych strupów (rys. 2 i 3). Ostatecznego potwierdzenia zakażenia lub kolonizacji przez gronkowca złocistego dostarcza mikrobiologiczne badanie wymazu ze skóry. Typową metodą laboratoryjną jest hodowla na agarze z krwią, dostępne są również testy do szybkiej identyfikacji bakterii (test lateksowy, test aglutynacji, testy API). W razie potrzeby leczenia doustnego powinno być ono poprzedzone wykonaniem antybiogramu, ponieważ gronkowiec złocisty szybko uodparnia się na coraz to nowe antybiotyki doustne oraz miejscowe [17,18]. Wskazane jest zbadanie obecności i w razie potrzeby eradykacja gronkowca złocistego z przedsionka nosa chorego, a niekiedy również badanie i leczenie osób z otoczenia chorego [9,19].
Ryc. 2. Siedmioletnia dziewczynka z nasilonym wypryskiem atopowym. Przeczosy na szyi powinny nasuwać podejrzenie kolonizacji gronkowcowej. Z archiwum Instytutu Dermatologii w Krakowie
|
Ryc. 3. Ręce i przedramiona tego samego dziecka. Rozsiane przeczosy w obrębie zmian wypryskowych pokryte zaschniętym żółtawym płynem wysiękowym nasuwają podejrzenie wyprysku zakażonego przez gronkowiec złocisty. Badanie mikrobiologiczne potwierdziło obecność gronkowca. Z archiwum Instytutu Dermatologii w Krakowie
|
W historycznej pracy z 1976 roku Wachs i Maibach [20] porównali skuteczność leczenia zakażonego wyprysku atopowego kortykosterydem, antybiotykiem oraz kombinacją obu tych leków, wykazując najwyższą skuteczność leczenia skojarzonego. Przytoczona obserwacja pozostaje w mocy do dnia dzisiejszego. Leczenie zakażenia gronkowcowego zajmuje istotne miejsce w aktualnych zaleceniach postępowania w wyprysku atopowym [21,22]. Miejscowe leczenie przeciwgronkowcowe może polegać na stosowaniu maści lub kremów z zawartością antybiotyków lub substancji odkażających. W przypadku rozległych zmian korzystniejsze może okazać się stosowanie kąpieli z dodatkiem środków bakteriobójczych. W tabeli 1 wymieniono przykłady środków przeciwbakteryjnych stosowanych w miejscowym leczeniu zakażenia/kolonizacji gronkowcowej. Niekiedy konieczne jest leczenie doustne antybiotykiem, który powinien być dobrany na podstawie antybiogramu w związku z narastająca antybiotykoopornością gronkowców [23].
W przypadkach "typowych", leczenie zakażonego wyprysku polega na naprzemiennym stosowaniu miejscowego antybiotyku i sterydu przez 2 tygodnie, a następnie kontynuacji leczenia samym sterydem przez kolejne 2 tygodnie [7]. Przykład bardzo rozbudowanego podejścia terapeutycznego podali Breuer i wsp. [9], którzy zastosowali u swoich chorych kombinację doustnej cefaleksyny, maści z chlorheksydyną na zmiany wypryskowe oraz skórę niezmienioną, maści z mupirocyną do nosa oraz codziennych kąpieli w roztworze nadmanganianu potasu. Leczenie według tego schematu doprowadziło do znamiennej redukcji objawów wyprysku mierzonych za pomocą skali SCORAD. W przypadku braku poprawy lub wręcz zaostrzenia wyprysku w trakcie leczenia zewnętrznego należy wziąć pod uwagę możliwość kontaktowego uczulenia na stosowane leki zewnętrzne [24]. Na przykład, na skutek powszechnego stosowania preparatów miejscowych neomycyny około 2% dzieci jest uczulone na ten antybiotyk [25].
| Substancja czynna | Postaci i stężenie substancji | Zastosowanie |
|---|---|---|
| Mupirocyna | Maść 2%, krem 2% | 2-3 razy dziennie na zmienioną chorobowo skórę, nie dłużej niż 10 dni |
| Kwas fusydowy | Maść 2%, krem 2% | 2-3 razy dziennie na zmienioną chorobowo skórę, nie dłużej niż 7 dni |
| Neomycyna | Aerozol 0,5% | 2-3 razy dziennie na zmienioną chorobowo skórę |
| Nadmanganian potasowy | Roztwór 0,05-0,1% | Okłady lub kąpiele 1-2 razy dziennie |
| Chlorheksydyna | Maść 0,5-1%, żel 1%, krem 1%, aerozol 0,5%, roztwór 0,5-1% | 2-3 razy dziennie na zmienioną chorobowo skórę lub kąpiele 1-2 razy dziennie |
| Chlorchinaldin | Maść 0,3% | 2-3 razy dziennie na zmienioną chorobowo skórę |
Leczenie przeciwgronkowcowe zajmuje szczególne miejsce w strategii leczenia wyprysku atopowego. Wykazano związek między zakażeniem (kolonizacją) skóry a nasileniem zmian wypryskowych. Działania zmierzające do usunięcia gronkowców ze skóry prowadzą do poprawy stanu klinicznego chorych, a ponadto zwiększają efektywność podstawowego leczenia kortykosterydami. Obecność zakażenia gronkowcowego należy podejrzewać zawsze, nawet przy braku cech klinicznych infekcji, ponieważ bakterię tę wykrywa u zdecydowanej większości chorych. W związku z szybkim rozwojem antybiotykooporności, leczenie powinno być poprzedzone analizą wrażliwości na rozważane leki gronkowca wyhodowanego ze skóry.
© Radoslaw Spiewak. (kontakt).
Ta strona jest częścią serwisu www.RadoslawSpiewak.net.
Document created: 27 June, last updated: 9 January 2017.